HERNÁNDEZ-BULE, PAÍNO CL, TRILLO MA, ÚBEDA A. CELL PHYSIOL BIOCHEM 2014;34:1741-1755
LA STIMOLAZIONE ELETTRICA A 448 kHZ PROMUOVE LA PROLIFERAZIONE DELLE CELLULE STAMINALI MESENCHIMALI UMANE
INTRODUZIONE
Le cellule precursori svolgono un ruolo fondamentale nella rigenerazione dei tessuti. Dopo la proliferazione, le nuove cellule recuperano la funzione originale del tessuto. Le cellule staminali mesenchimali (MSC) costituiscono una popolazione cellulare fondamentale coinvolta nella fase proliferativa della rigenerazione delle lesioni e sono presenti in quasi tutti i tessuti adulti.
Le terapie fi siche basate sulla stimolazione elettrica o elettromagnetica solitamente utilizzate hanno dato risultati soddisfacenti nella rigenerazione delle lesioni tissutali traumatiche o degenerative e in medicina estetica (1-7). Tra queste terapie, il Trasferimento energetico capacitivo resistivo (TECAR) è una strategia elettro-termica non invasiva basata sull’applicazione di correnti elettriche nell’intervallo di radiofrequenza compreso tra 400 kHz e 450 kHz.
Recenti risultati in vitro indicano che, quando viene somministrata a densità di corrente termica, la TECAR causa citotossicità nelle cellule tumorali umane, effetto termico che è potenziato dall’iniezione di microparticelle metalliche all’interno dei tessuti tumorali bersaglio (8). A livello cellulare, gli effetti della Tecarterapia non sono limitati soltanto a quelli termici. La stimolazione della TECAR a dosi subtermiche (senza calore) può indurre risposte anti-proliferative e citotossiche in linee cellulari tumorali umane coltivate, ma non in colture primarie di cellule mononucleate di sangue umano periferico (9-13). Questi risultati sperimentali avvalorano l’evidenza disponibile secondo la quale gli effetti della Tecarterapia non dipendono esclusivamente dall’aumento della temperatura, ma anche dalle risposte cellulari dirette allo stimolo elettrico stesso. In
merito alla rigenerazione dei tessuti, la Tecarterapia è attualmente utilizzata nella riabilitazione fi sica e nella medicina sportiva per curare le lesioni muscolari, ossee, legamentose e tendinee (14-16).
Le lesioni sottoposte a Tecarterapia guariscono più rapidamente e mostrano una riduzione generale dell’area danneggiata, associata a processi antifl ogistici, effetti analgesici e recupero della funzionalità muscolare (17-20).
L’obiettivo di questa ricerca è studiare se la promozione della proliferazione cellulare sia uno dei fenomeni coinvolti nella rigenerazione dei tessuti indotta da Tecarterapia a densità di corrente subtermica nelle cellule staminali derivate dal tessuto adiposo (ADSC), un tipo di MSC.
MATERIALI E METODI
Coltura cellulare
Le cellule staminali derivate dal tessuto adiposo sono state isolate da campioni di grasso sottocutaneo provenienti da quattro donatori sani (due uomini, di età compresa tra 65 e 69 anni e due donne, di età compresa tra 29 e 35 anni). Negli esperimenti sono state utilizzate le ADSC dai passaggi 3-8.
Esposizione alla TECAR
L’esposizione cellulare (come illustrato nella Figura 1) alle correnti TECAR consisteva in impulsi di 5 minuti di corrente a 448 kHz a una densità subtermica di 50 μA/mm2, separati da periodi di inter-impulsi di 4 ore, per una durata complessiva di 48 ore. Studi precedenti condotti dal nostro gruppo avevano dimostrato che tali parametri di esposizione influenzavano la proliferazione cellulare (9-13). Le colture sono state effettuate in incubatrici e monitorate costantemente. Per l’esposizione simulata le coppie di elettrodi inserite nei piatti di controllo sono state collegate al generatore, ma non energizzate.
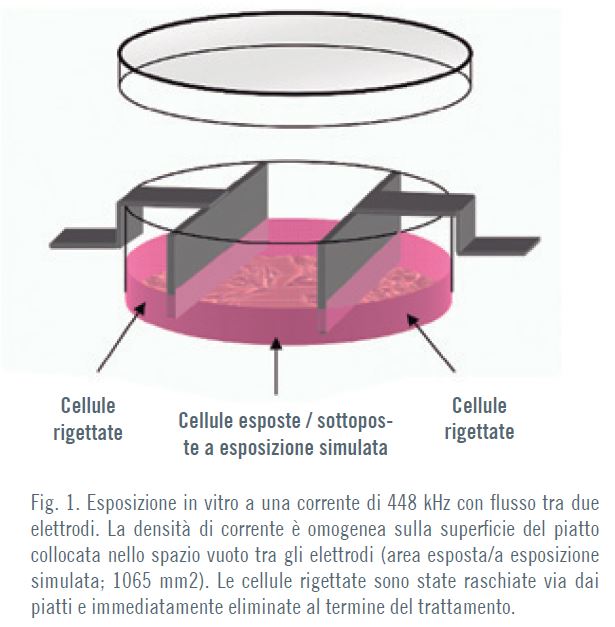
Saggio di differenziamento per la caratterizzazione mesenchimale
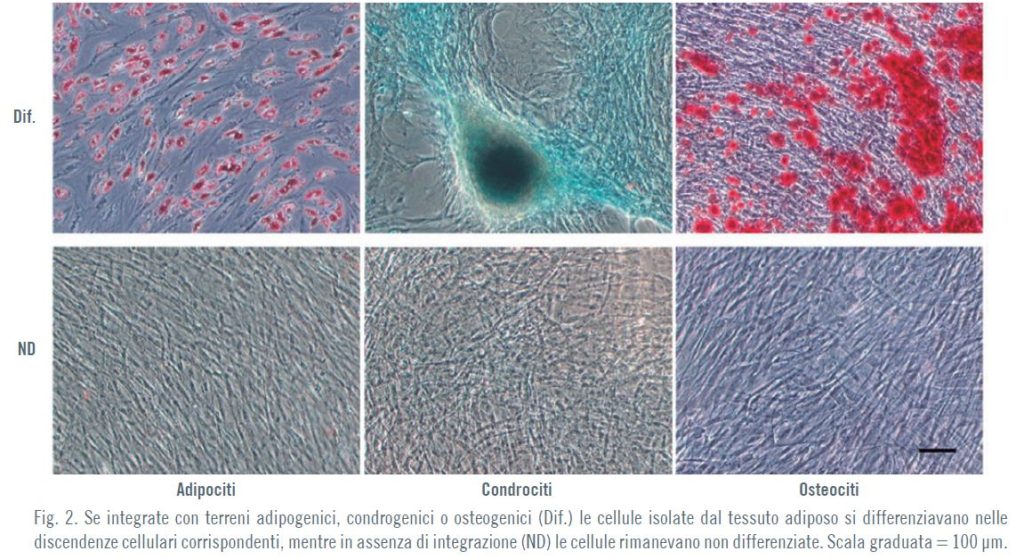
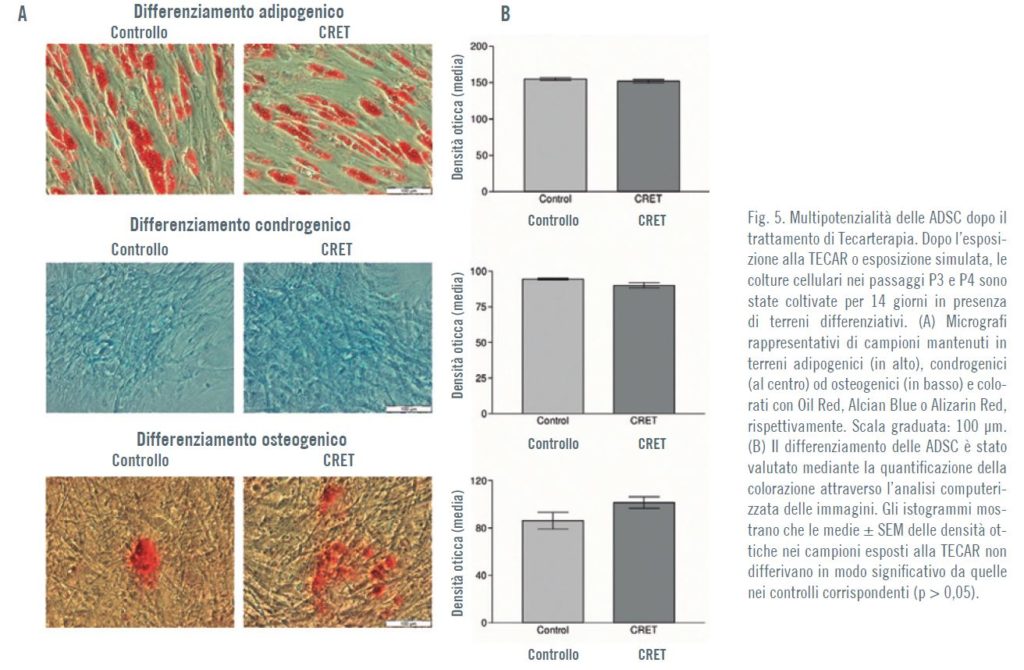
Per valutare la multipotenzialità differenziativa delle ADSC ottenute, le cellule sono state incubate in un terreno adipogenico, condrogenico o osteogenico. Al 15° giorno di incubazione nei rispettivi terreni differenziativi, le ADSC sono state fi ssate per valutare il differenziamento adipogenico, condrogenico od osteogenico.
La stessa procedura di valutazione del differenziamento è stata applicata per analizzare se la multipotenzialità delle ADSC poteva essere influenzata dall’esposizione alla TECAR.
Valutazione della proliferazione cellulare
L’effetto della TECAR sulla proliferazione cellulare è stato determinato mediante il saggio colorimetrico XTT e la quantifi cazione della sintesi di DNA attraverso la rivelazione dell’immunofl uorescenza della 5-bromodeossiuridina (BrdU) incorporata.
Analisi del ciclo cellulare
Gli effetti potenziali del trattamento sul ciclo cellulare sono stati valutati mediante la citometria a fl usso utilizzando le colture ai passaggi P3 e P4. Per analizzare le cellule che subiscono la fase del ciclo cellulare S e G2 è stato utilizzato l’antigene nucleare di proliferazione cellulare (PCNA) che è un marcatore proteico associato alla DNA polimerasi (21).
RISULTATI
Differenziamento adipogenico, condrogenico e osteogenico delle ADSC
Le ADSC hanno mostrato modelli evidenti di differenziamento nelle tre discendenze cellulari studiate: adipociti, condrociti od osteociti (Fig. 2).
Proliferazione TECAR
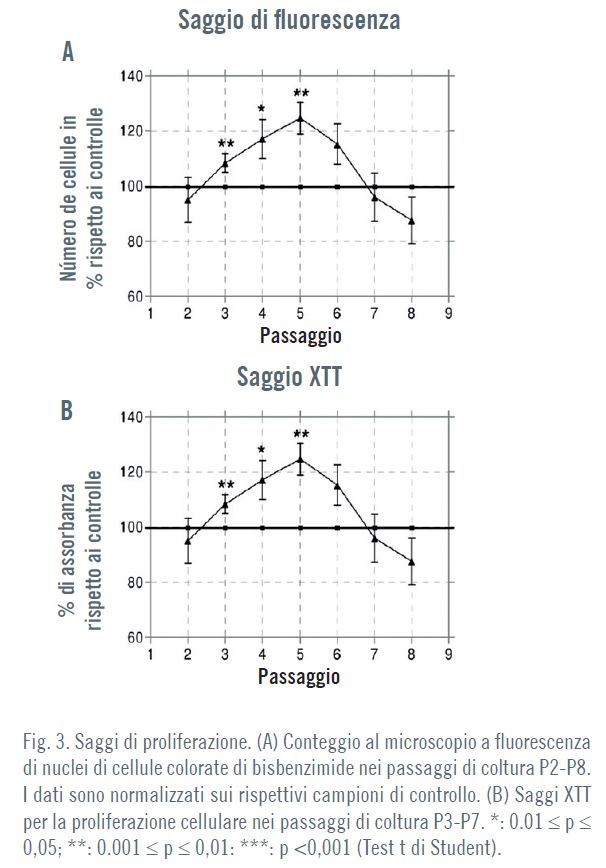
L’effetto della TECAR dipendeva dal passaggio della coltura.
Le ADSC trattate nei passaggi P3-P5 mostravano aumenti statisticamente rilevanti del numero di cellule, raggiungendo un
incremento del 25% sui controlli sottoposti a esposizione simulata nel passaggio P5 (Fig. 3A). Il saggio colorimetrico XTT ha
confermato un aumento del numero di cellule fi no al 20% rispetto ai controlli nelle colture trattate ai passaggi P3-P5 (Fig. 3B)
La proporzione di BrdU+ cellule nel gruppo trattato presentava un signifi cativo aumento del 38 % rispetto a quella dei controlli (p < 0,001)..
Analisi del ciclo cellulare
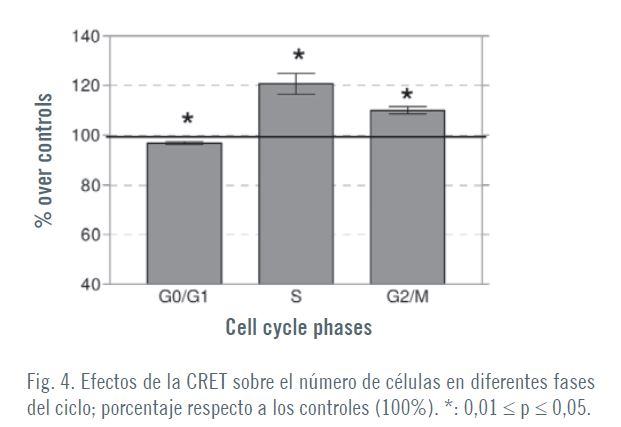
Riguardo agli effetti della TECAR sul ciclo cellulare, nei passaggi P3-P5 si è verifi cato un calo modesto (3%), ma statisticamente rilevante, nella proporzione di cellule nella fase G0/G1, accompagnato da aumenti statisticamente rilevanti (21% e 10% sui controlli) di cellule nelle fasi S e G2/M, rispettivamente (Fig. 4). Tali dati sono stati avvalorati dal conteggio PCNA di cellule positive, dove la TECAR produceva un incremento statisticamente signifi cativo (35%) rispetto ai controlli.
Multipotenzialità delle ADSC dopo il trattamento di Tecarterapia
Dopo due settimane di incubazione post-esposizione in presenza dei corrispondenti terreni differenziativi, i modelli di differenziamento nei campioni esposti alla TECAR non differivano molto da quelli dei controlli (Fig. 5)
CONCLUSIONI
Questi risultati indicano che l’esposizione intermittente a uno stimolo elettrico di 448 kHz di Tecarterapia (Trasferimento energetico capacitivo resistivo) aumenta le percentuali di cellule nelle fasi S, G2 e mitosi e promuove la proliferazione nelle cellule staminali mesenchimali umane. I risultati ottenuti evidenziano che la Tecarterapia promuoveva la rigenerazione dei tessuti mediante l’attivazione della proliferazione di cellule staminali quiescenti (ADSC) presenti nell’area danneggiata senza compromettere la multipotenzialità delle cellule staminali per il successivo differenziamento adipogenico, condrogenico od osteogenico. Questi dati, unitamente all’evidenza sperimentale precedentemente pubblicata, avvalorano fortemente l’ipotesi che i meccanismi molecolari e cellulari diversi da quelli termici possano essere fondamentali per l’efficacia terapeutica dei trattamenti con Tecarterapia, compresi quelli applicati alla riparazione dei tessuti.
Riassumendo, tutti i risultati contenuti nel presente lavoro indicano che la Tecarterapia può promuovere o accelerare la riparazione delle lesioni stimolando la proliferazione delle cellule staminali già in espansione. Ne consegue che la Tecarterapia può essere applicata come valido adiuvante per il recupero di numerose lesioni tissutali o vascolari o come trattamento opzionale per i pazienti che sono sensibili agli effetti collaterali di alcune chemioterapie. La Tecarterapia
potrebbe anche essere utile nei trattamenti antiflogistici.
BIBLIOGRAFIA
1 Messerli MA, Graham DM: Extracellular electrical fi elds direct wound healing and regeneration. Biol Bull 2011;221:79-92.
2 Pilla AA: Nonthermal electromagnetic fi elds: From fi rst messenger to therapeutic applications. Electromagn Biol Med 2013;32:123-136.
3 Belenky I, Margulis A, Elman M, Bar-Yosef U, Paun SD: Exploring channeling optimized radiofrequency energy: A review of radiofrequency history and applications in esthetic fi elds. Adv Ther 2012;29:249-266.
4 Boyette MY, Herrera-Soto JA: Treatment of delayed and nonunited fractures and osteotomies with pulsed electromagnetic fi eld in children and adolescents. Orthopedics 2012;35:e1051-1055.
5 Whipple TL: From mini-invasive to non-invasive treatment using monopolar radiofrequency: The next orthopaedic frontier. Orthop Clin North Am 2009;40:531-535, x.
6 Conner-Kerr T, Isenberg RA: Retrospective analysis of pulsed radiofrequency energy therapy use in the treatment of chronic pressure ulcers. Adv Skin Wound Care 2012;25:253-260.
7 Lolis MS, Goldberg DJ: Radiofrequency in cosmetic dermatology: A review. Dermatol Surg 2012;38:1765- 1776.
8 San BH, Moh SH, Kim KK: Investigation of the heating properties of platinum nanoparticles under a radiofrequency current. Int J Hyperthermia 2013;29:99-105.
9 Hernandez-Bule ML, Trillo MA, Bazan E, Martinez-Pascual MA, Leal J, Ubeda A: Nonthermal levels of electric currents applied in capacitive electric transfer therapy provokes partial cytotoxic effects in human neuroblastoma cultures. Neurocirugia (Astur) 2004;15:366-371; discussion 371.
10 Hernandez-Bule ML, Trillo MA, Cid MA, Leal J, Ubeda A: In vitro exposure to 0.57 MHz electric currents exerts cytostatic effects in HepG2 human hepatocarcinoma cells. Int J Oncol 2007;30:583-592.
11 Hernandez-Bule ML, Cid MA, Trillo MA, Leal J, Ubeda A: Cytostatic response of HepG2 to 0.57 MHz electric currents mediated by changes in cell cycle control proteins. Int J Oncol 2010;37:1399-1405.
12 Hernandez-Bule ML, Roldan E, Matilla J, Trillo MA, Ubeda A: Radiofrequency currents exert cytotoxic effects in NB69 human neuroblastoma cells but not in peripheral blood mononuclear cells. Int J Oncol 2012;41:1251-1259.
13 Hernandez-Bule ML, Trillo MA, Ubeda A: Molecular mechanisms underlying antiproliferative and differentiating responses of hepatocarcinoma cells to subthermal electric stimulation. PLoS One 2014;9:e84636.
14 Ganzit GP, Stefanini L, Stesina G: Nuove methodice nei trattamento della patología muscolo-articolare dell´atleta: La tercaterapia. Med Sport 2000;53:361-367.
15 Melegati G, Volpi P, Tornese D, Mele G: Rehabilitación en patologías del tendón. Revista del Deporte, Investigación de traumatología e investigaciones afi nes 1999;21:66-83.
16 Mondardini P, Tanzi R, Verardi L, Briglia S, Maione A, Draco E: Nuove metodología nel trattamento della patología muscolare traumática dell´atleta. Med Sport 1999;52:201-213.
17 Takahashi K ST, Onodera M, Hirabayashi S, Tsuzuki N, Zhong-Shi L: Clinical effects of capacitive electric transfer hyperthermia therapy for lumbago. J Phys Ther Sci 1999;11
18 Takahashi K ST, Onodera M, Hirabayashi S, Tsuzuki N, Zhong-Shi L: Clinical effects of capacitive electric transfer hyperthermia therapy for cervico- omo-brachial pain. J Phys Ther Sci 2000;12:43-48.
19 Arnedo F, Andrew A, Till L, Sendrós S, Hellín S: Radiofrecuencia monopolar capacitiva/resistiva 448 kHz (indiba activ therapy) en el tratamiento rehabilitador de lesiones de la musculatura isquitibial derivada de la práctica deportiva: XIV Congreso Nacional de la Federación Española de Medicina del Deporte. Santander, Spain, 2012, XXIX, pp 915.
20 Sust F, Linde X, Sendrós S, Figueras G, Till L: Radiofrecuencia monopolar capacitiva/resistiva 448 kHz (indiba activ therapy) en el tratamiento de lesiones músculo-tendinosas: XIV Congreso Nacional de la Federación Española de Medicina del Deporte. Santander, Spain, 2012, XXIX, pp 915.
21 Woods AL, Hall PA, Shepherd NA, Hanby AM, Waseem NH, Lane DP, Levison DA: The assessment of proliferating cell nuclear antigen (PCNA) immunostaining in primary gastrointestinal lymphomas and its relationship to histological grade, S, G2, M phase fraction (fl ow cytometric analysis) and prognosis. Histopathology 1991;19:21-27.

Commenti recenti