M. A. Trillo, S de Bernardo,
A. Úbeda, M.A. Martinez,
E. Bazán and J. Leal
Dept. Inverstigatión, Hospital Ramón y Cajal, Madrid
CAMBIAMENTI NEL CICLO CELLULARE DI LINEE TUMORALI UMANE,
ESPOSTE A CORRENTI DI 0.5-MHz
SCOPO
Lo scopo di questo lavoro è di caratterizzare la risposta in vitro delle cellule di epatocarcinoma umano HepG2 e di neuroblastoma umano NB69 ai segnali elettrici di radiofrequenza (RF), utilizzati nella terapia di patologie muscolari e tendinee.
In uno studio parallelo Úbeda et al. hanno dimostrato che l’esposizione per breve periodo a segnali di 0.57-MHz in un intervallo di densità di corrente di 10 – 150 μA/mm2 riducono in modo significativo la velocità di crescita delle cellule HepG2 e la vitalità cellulare delle NB69, senza aumentare la temperatura del terreno di coltura (t < 0.1°C). Questi dati suggeriscono che le risposte osservate possano essere mediate da modificazioni sul ciclo cellulare, non indotte dal calore.
METODO
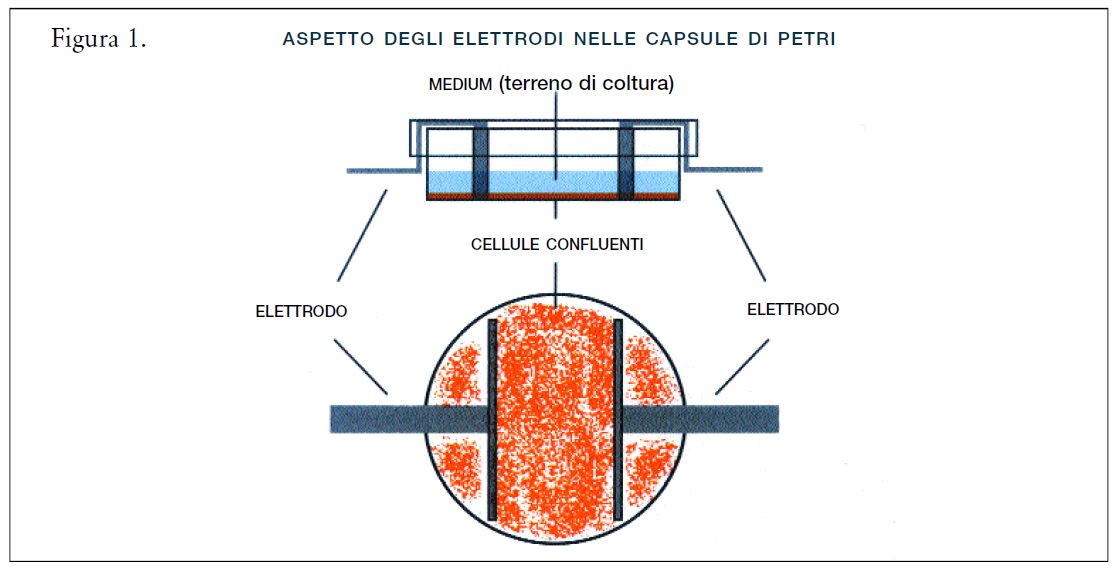
Le cellule tumorali umane HepG2 e NB69 erano state seminate in vetrini coprioggetto di 12 mm di diametro, posizionate in capsule di Petri (2/capsula). Quando le colture avevano raggiunto il 75% di confluenza, sia nelle capsule di Petri di controllo sia nei positivi venivano inserite coppie di elettrodi sterili, in modo che solo un vetrino coprioggetto si trovasse nell’area compresa tra gli elettrodi. In ciascuna delle tre repliche dei controlli positivi, 5 capsule di Petri erano state esposte per 24 ore a brevi impulsi di segnali di 0.5-MHz, a una densità di corrente di 100 μA/mm2 che, come è noto, influiscono sulla velocità di crescita delle cellule HepG2 e sulla vitalità delle NB69. Nelle restanti 5 capsule di Petri di controllo, non vi era
differenza di potenziale tra gli elettrodi. Per la valutazione istologica, i campioni nei vetrini coprioggetto venivano fissati, disidratati e contrastati con ematoxilina. Per poter effettuare l’analisi fotomicroscopica venivano processati 30 campioni esposti e 30 di controllo per linea cellulare. Il numero di metafasi veniva calcolato indipendentemente e in cieco rispetto al trattamento. La determinazione delle metafasi veniva effettuata su 500 cellule per ogni campione e veniva elaborata l’analisi statistica con il test del X2.
RISULTATI E DISCUSSIONE
Lo studio dei campioni esposti nei vetrini coprioggetto, localizzati tra gli elettrodi, mostrava un aumento significativo nel numero delle cellule in metafase rispetto alle cellule di controllo: 238% e 146% per le linee cellulari HepG2 e NB69, rispettivamente (per entrambe p < 0.01). Questo non si verificava nelle cellule seminate in zone esterne all’intervallo tra gli elettrodi.
Con i dati esposti da Úbeda et al., questi risultati dimostrano che l’esposizione a correnti di 100 μA/mm2 a 0.57-MHz sono in grado di ridurre in modo significativo o di arrestare il ciclo mitotico in entrambe le linee cellulari HepG2 e NB69. Questo effetto può determinare un danno cellulare permanente, che è coerente con gli effetti citotossici/citostatici osservati in queste linee cellulari di cancro umano, dopo essere state sottoposte a trattamento con correnti elettriche deboli di 0.57-MHz.
INTRODUZIONE
Quando si considerano i mezzi per trasmettere energia termica ai tessuti in modo puntuale, solo l’ipertermia da RF e MW presenta delle potenzialità reali o permette un’accurata terapia non invasiva. Il nuovo sistema terapeutico per mezzo del Trasferimento Energetico Capacitivo e Resistivo consiste nell’indurre un aumento della temperatura, in punti selettivi dei tessuti, mediante correnti di RF. Questi segnali elettrici sono utilizzati per la terapia delle patologie muscolari e tendinee. I saggi tossicologici sulle
due linee tumorali umane, HepG2 e NB69, esposte a segnali di RF non termici, utilizzati generalmente nella Tecarterapia, hanno dimostrato che essi provocano effetti citotossici/citostatici in tali linee cellulari (Úbeda et al., 2000).
I dati indicano che le correnti di RF a livelli non termici possono avere degli effetti sulla proliferazione nelle cellule tumorali umane.
Lo scopo di questo lavoro è di studiare i possibili cambiamenti nella proliferazione cellulare delle linee tumorali umane, esposte alle correnti elettriche di RF, delle quali si è discusso. In uno studio parallelo Úbeda et al. (2000) hanno mostrato che l’esposizione per breve periodi a segnali di 0.57-MHz in un intervallo di densità di corrente di 10-100 μA/mm2 riducono in modo significativo la velocità di crescita delle cellule HepG2 e la vitalità cellulare delle NB69, senza aumentare la temperatura del terreno di
coltura ( t < 0.05°C). In questo lavoro valuteremo i possibili cambiamenti nella proliferazione delle cellule di neuroblastoma NB69 e di epatocarcinoma HepG2, esposte a correnti di RF di 100 μA/ mm2.
METODI
Sono stati utilizzati due metodi per valutare gli effetti sulla proliferazione cellulare:
1) QUANTIFICAZIONE DEL NUMERO DI METAFASI
– Le cellule HepG2 e NB69 sono state seminate in vetrini coprioggetto di 12 mm di diametro, posizionati in capsule di Petri (2/capsula).
– Quando le colture avevano raggiunto il 75% di confluenza, sia nelle capsule di Petri di controllo sia in quelle dei controlli positivi sono state inserite coppie di elettrodi sterili, in modo che solo un vetrino coprioggetto si trovasse nell’intervallo compreso tra gli elettrodi (Figura 2).
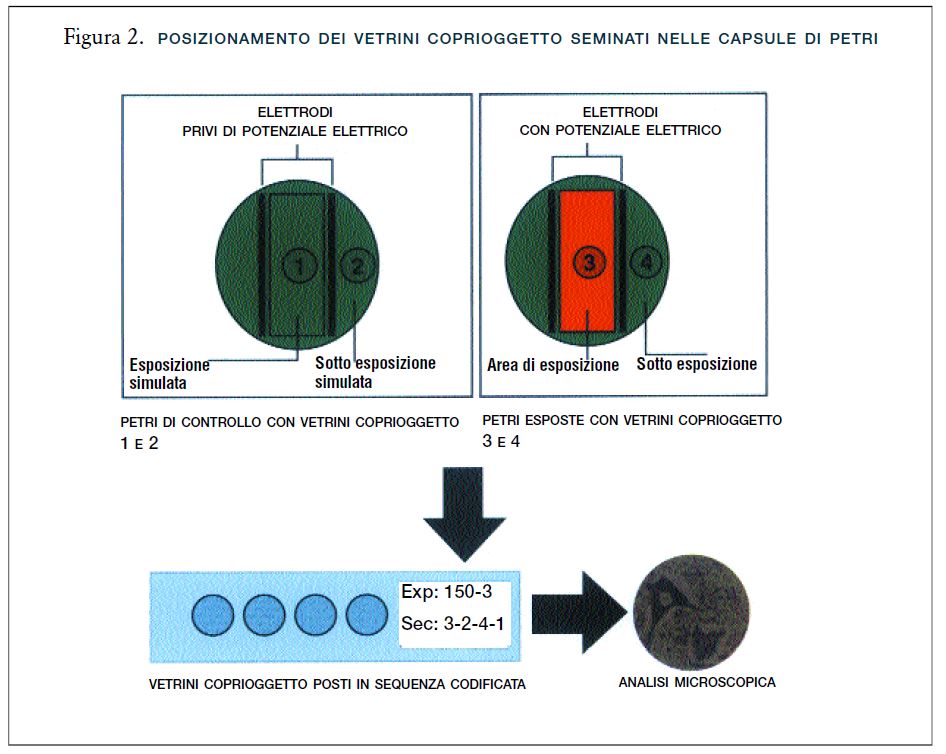
In ciascuna delle tre repliche dei controlli positivi, 5 capsule di Petri erano state esposte per 24 ore a brevi impulsi di segnali di 0.6-MHz, a una densità di corrente di 100 μA/mm2. Nelle restanti 5 capsule di Petri di controllo, non vi era differenza
di potenziale tra gli elettrodi.
– Per la valutazione citologica, i campioni nei vetrini coprioggetto venivano fissati, disidratati e contrastati con ematoxilina.
Per l’analisi fotomicroscopica venivano processati 30 campioni esposti e 30 di controllo per linea cellulare.
– Il numero di metafasi veniva calcolato indipendentemente e in cieco rispetto al trattamento.
L’indice di metafase veniva studiato su 500 cellule per vetrino coprioggetto e per l’analisi statistica veniva applicato il X2.
2) INCORPORAZIONE DEL MARCATORE IMMUNOCHIMICO 5-BROMO-2’-DEOSSIURIDINA (BRDU)
– Le cellule HepG2 e NB69 sono state seminate in vetrini coprioggetto di 12 mm di diametro, posizionate in capsule di Petri (2/capsula).
– Quando le colture avevano raggiunto il 75% di confluenza, in tutte le capsule di Petri, controllo negativo e positivo, sono state inserite coppie di elettrodi sterili, in modo che ogni vetrino coprioggetto si trovasse nell’intervallo compreso tra gli elettrodi.
– In ciascuna delle due repliche dei controlli positivi, 5 capsule di Petri erano state esposte per 24 ore a brevi impulsi di segnali di 0.6-MHz, a una densità di corrente di 100 μA/mm2. Nelle restanti 5 capsule di Petri di controllo, non vi era differenza di potenziale tra gli elettrodi.
– Le cellule marcate con BrdU venivano rilevate con colorazione immunocitochimica, utilizzando un anticorpo monoclonale anti-BrdU.
– Il numero di cellule positive per BrdU venivano misurate in cieco con microscopio a fluorescenza.
Venivano analizzati in totale 40 vetrini coprioggetto (20 controlli + 20 esposti).
– La determinazione dei positivi per BrdU/vetrino coprioggetto veniva effettuata su un totale di 122.247 ± 11.913 cellule di controllo e 129.315 ± 12.369 cellule esposte. Per l’analisi statistica era applicato il test del !2.
RISULTATI
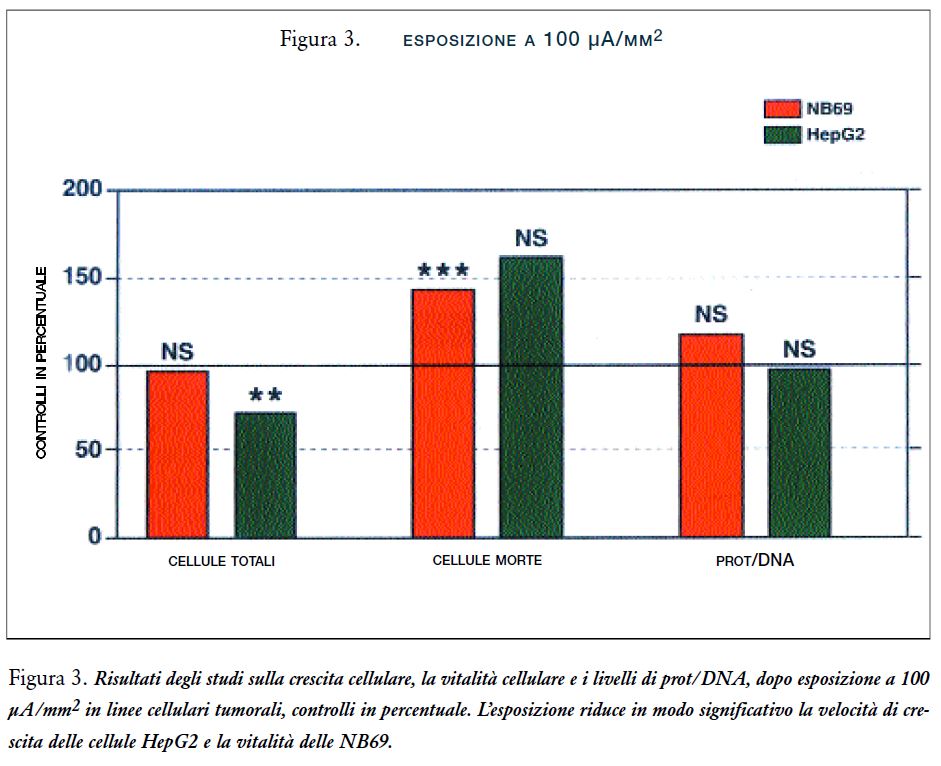
Lo studio della crescita e della vitalità cellulare (Figura 3) conferma gli effetti osservati negli esperimenti precedenti (Poster-69) nelle linee cellulari HepG2 e NB69.
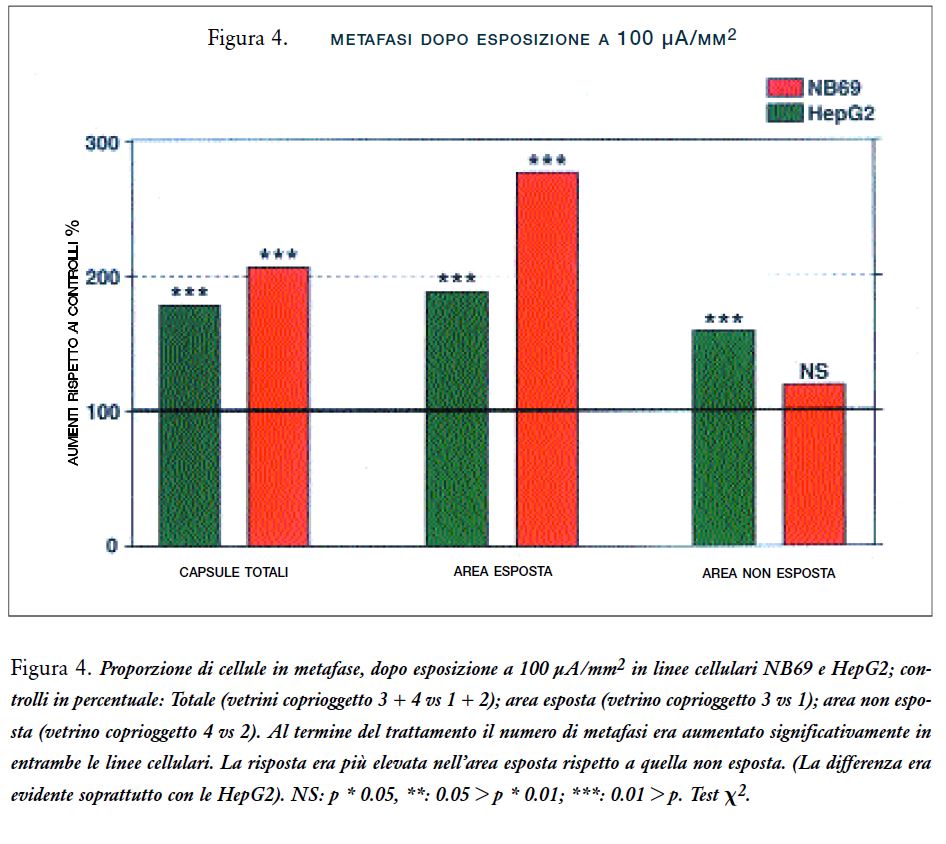
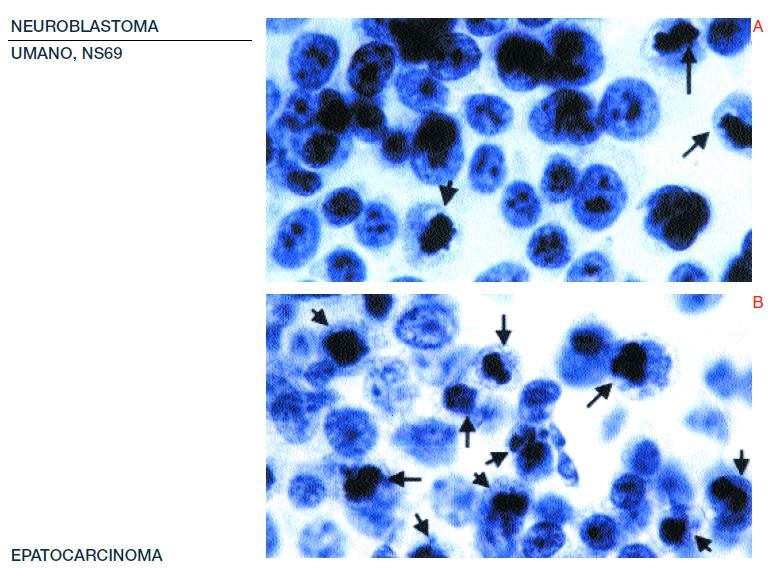
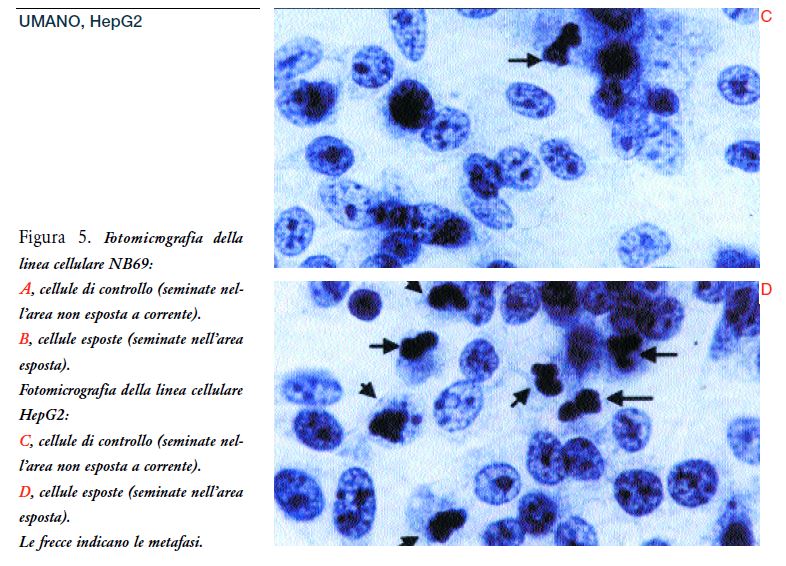
Le analisi di metafase nei campioni tra gli elettrodi mostra un significativo aumento nel numero di cellule in metafase, se confrontate ai controlli negativi: aumenti del 238% e del 146% per le linee HepG2 e NB69, rispettivamente (per entrambe la p<0.01) (Figura 4). Questa risposta non si verificava nelle cellule al di fuori dell’area tra gli elettrodi. La cromatina in qualche cellula HepG2 e NB69 in metafase appariva condensata in modo anomalo e/o disaggregata (Figure 5 A, B, C, D).
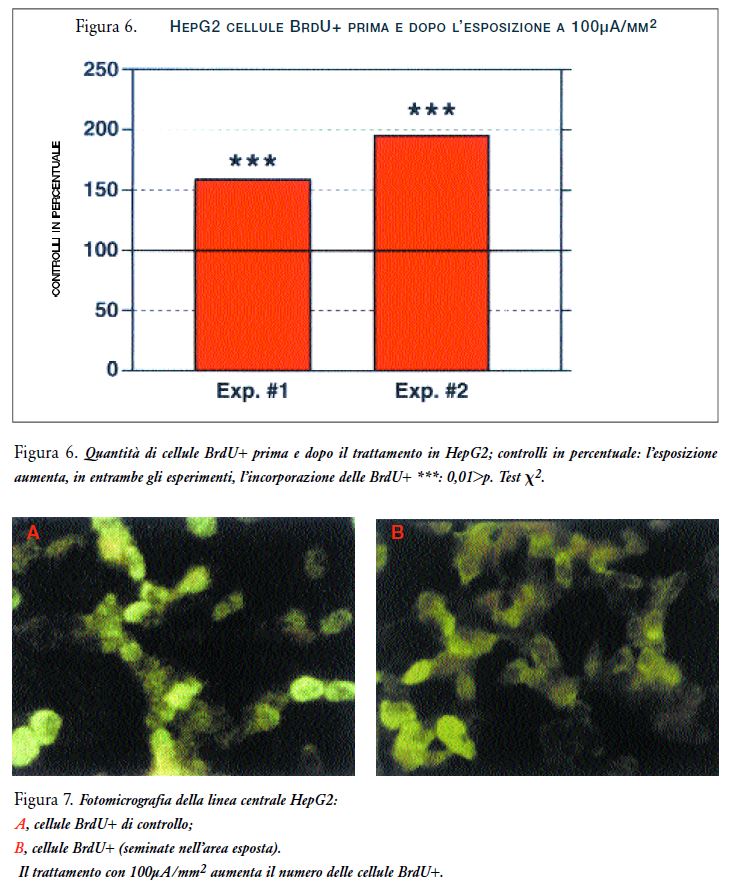
Questo suggerirebbe un effetto dannoso che potrebbe essere responsabile degli effetti citotossici/citostatici, osservati nella crescita e nella vitalità cellulare (Figura 3) (Poster-69), dopo il trattamento con correnti elettriche deboli di 0.6-MHz. L’incorporazione del BrdU nelle cellule HepG2, esposte tra gli elettrodi, mostrava un aumento significativo delle cellule BrdU positive rispetto ai controlli, aumenti del 157% e 194% nel Exp#1 e Exp#2, rispettivamente (per entrambi la p<0.001) (Figure 6 e 7 A e B). Ne consegue che la somministrazione del trattamento nelle cellule HepG2 causa un aumento nell’incorporazione del BrdU ma non un aumento della densità cellulare.
Questo effetto può determinare un danno cellulare permanente, che è coerente con gli effetti citotossici/citostatici osservati in queste linee cellulari tumorali umane, dopo essere state sottoposte a trattamento con correnti elettriche deboli di 0.6-MHz.
CONCLUSIONI
– Insieme con i dati che accompagnano lo studio di Úbeda et al. (2000), i presenti risultati indicano che l’esposizione a 100μA/mm2 di correnti a 0,57 MHz può inibire la proliferazione cellulare in vitro in quanto interferisce nella progressione
del ciclo cellulare in entrambe le cellule Hepg2 e NB69.
– Questi risultati rappresentano un indice sperimentale dell’azione citotossica nelle cellule cancerogene esposte a correnti atermiche di radiofrequenza generate attraverso un metodo terapeutico del Trasferimento Energetico Capacitivo e Resistivo. La comprensione di alcuni principi base della fisica riguardanti il trattamento atermico di radiofrequenza e/o i vantaggi fisici di questo metodo attraverso la ricerca sperimentale può aprire nuove vie all’esplorazione dello sviluppo di tecniche cliniche nel trattamento del cancro.
BIBLIOGRAFIA
1. ÚBEDA, A., DE BERNARDO, S., BAZÁN E., TRILLO, M. A., MARTÍNEZ, M. A., LEAL, J. (2000).
Cytostatic Effects in human cancer cells exposed in vitro to 0.5- MHz electric currents. BEMS Twenty-Second annual Meeting, Munich June 11-16
2. TRILLO, M. A., DE BERNARDO, S., ÚBEDA, A., MARTÍNEZ, M. A., BAZÁN E., LEAL, J; (2000).
Changes in the cell cycle of human cancer lines exposed to 0.5-MHz currents. BEMS Twenty-Second annual Meeting, Munich June 11-16
3. ÚBEDA, A., DE BERNARDO, S., BAZÁN E., TRILLO, M. A., MARTÍNEZ, M. A., LEAL, J. (2000).
Assay of biocompatibility for RF generated by a System for clinical applications of hypertermia. The Third World Congress for Electricity and Magnetism in Biology and Medicine
4. TRILLO, M. A., DE BERNARDO, S., ÚBEDA, A., MARTÍNEZ, M. A., BAZÁN E., LEAL, J. (2000).
Changes in the cell cycle of human cancer lines exposed to RF used in therapy with capacitive-resistive electric transfer
(TECAR Therapy). The Third World Congress for Electricity and Magnetism in Biology and Medicine.
5 . BA LLES T ER, F., F.; (2001).
Aplicación de la Transferencia Eléctrica Capacitiva en Oftalmología (T.E.R.). Revista de D’Or de Oftalmología. 2º trimestre
del 2001. Pág. 43-49
6. MONDARDINI ET AL. (1999).
La Riabilitazione Verso il 2000, Bologna
7. CALPE J., GARCÍA C., HERNÁNDEZ R., GASPAR M., ROTELLAR E. (1998).
Nuestra experiencia con un recuperador electrónico en lesions vasculares de pacientes hemodializados. SEDYT. XIX/2, 19-22 (1998)

Commenti recenti